Por Erika Edwards – NBC News
La autorización del uso de emergencia de las vacunas de COVID-19 para menores de 12 años podría llegar entre principios y mediados del invierno, según un funcionario de la Administración de Alimentos y Medicamentos (FDA, en inglés) que habló este jueves con la cadena NBC News.
La agencia espera avanzar rápidamente en la aprobación de la inmunización en este grupo de edad. Una de las principales preocupaciones de las familias que tienen dudas sobre las vacunas, dijo el funcionario, es que actualmente se están aplicando bajo una autorización de emergencia porque todavía no tienen la aprobación completa de la FDA. La aprobación total, si llega poco después de las rondas de emergencia, podría aliviar esa preocupación.
[Siga aquí nuestra cobertura sobre la pandemia de coronavirus y la campaña de vacunación]
Hasta ahora las vacunas contra el COVID-19 solo han sido autorizadas en Estados Unidos para los mayores de 12, pero ningún grupo poblacional ha recibido la autorización completa de la FDA.
Tanto Moderna como Pfizer-BioNTech ya iniciaron los estudios clínicos con niños de menos de 12 en marzo y esperan obtener los resultados en otoño. Luego la FDA tendrá que revisar la evidencia que presentan las compañías en sus solicitudes de aprobación.

La agencia reguladora requiere que las farmacéuticas presenten datos que abarquen de cuatro a seis meses de monitoreo sobre la seguridad de la inyección en los menores, explicó el funcionario de la FDA. En los ensayos clínicos en adultos, basta con que presenten datos de dos meses de seguimiento.
Esos meses adicionales de seguimiento podrían facilitar el proceso de la aprobación final, que requiere un monitoreo de al menos seis meses tras el cual se otorga una licencia para vender productos biológicos.
Hasta ahora, solo Pfizer-BioNTech ha solicitado la licencia completa de su vacuna para adultos mayores de 18 años. El funcionario de la FDA dijo que otorgar la aprobación final a los adultos es la máxima prioridad de la agencia en este momento.
Pfizer espera tener los resultados de sus ensayos clínicos en niños de entre 5 y 11 años en septiembre, según lo informó a NBC News en un comunicado. Después de eso podría solicitar la autorización para el uso de emergencia.
"Los datos para niños de entre 2 y menos de 5 años podrían llegar poco después", dijo la compañía, y agregó que los resultados de niños de 6 meses a 2 años podrían no publicarse hasta octubre o noviembre.
[Mamá cuenta cómo su bebé se contagió de COVID-19 en la guardería]
El doctor Buddy Creech, uno de los principales investigadores en los ensayos clínicos de Moderna KidCOVE, que incluyen a niños de hasta 6 meses, también dijo que podrían tener los datos disponibles en otoño.
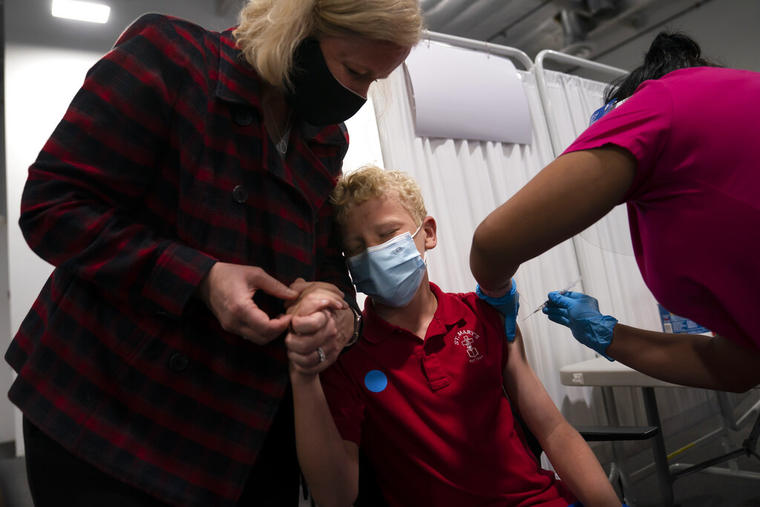
Contar con una vacuna segura y eficaz para los niños pequeños es una herramienta importante para detener la propagación del COVID-19, especialmente ante la rápida propagación de la variante delta, que es más infecciosa.
Aunque no hay indicios de que la variante delta haga que el virus sea más peligroso en los niños, su naturaleza altamente contagiosa significa que todas las personas no vacunadas son más vulnerables, incluidos los menores de 12.
"Dado que los niños son uno de los grupos que no están vacunados, veremos más casos en niños", explicó el doctor Richard Besser, pediatra y exdirector interino de los Centros para el Control y la Prevención de Enfermedades. "Veremos más hospitalizaciones de niños y, lamentablemente, veremos más muertes de niños", agregó.
Besser, quien es el actual presidente de la Fundación Robert Wood Johnson, espera que la FDA avance pronto en la aprobación final de las vacunas.
"Muchas personas afirman que eso influye en su decisión de no vacunarse", aclaró.
Sin embargo, algunos especialistas en enfermedades infecciosas pediátricas no están convencidos de que la aprobación total -en lugar de la de emergencia- tenga un gran impacto en los que están indecisos.
[Pfizer y la FDA debaten sobre la aplicación de una tercera dosis de la vacuna contra el COVID-19]
"En términos de cómo se aprueban las vacunas, no hay mucha diferencia funcional" entre la autorización de uso de emergencia y la aprobación total, dijo el doctor Sean O'Leary, vicepresidente del Comité de Enfermedades Infecciosas de la Academia Estadounidense de Pediatría.
Hasta el 8 de julio, más de cuatro millones de niños habían sido diagnosticados con COVID-19, lo que representa el 14.2% de todos los casos, según la Academia Estadounidense de Pediatría. Al menos 335 niños, de 17 años o menos, han muerto a causa de Covid-19, según los últimos datos de los CDC.