Por Aria Bendix - NBC News
La Administración de Alimentos y Medicamentos (FDA, en inglés) aprobó este miércoles la primera vacuna en el mundo contra el virus respiratorio sincital (VRS) para personas de 60 años o más, desarrollada por la farmacéutica GSK y que se aplica en una dosis.
La vacuna es el fruto de seis décadas de investigación contra esta enfermedad de las vías respiratorias, que suele ser leve para los adultos sanos pero puede provocar neumonía o bronquiolitis (que inflama las vías respiratorias y las obstruye con mucosidad). Los adultos mayores y los bebés corren más riesgo: el VRS mata hasta 10,000 personas de 65 años o más y hasta 300 niños menores de 5 años cada año en Estados Unidos.
En un amplio estudio clínico, una dosis de la nueva vacuna redujo el riesgo de una enfermedad con síntomas en un 83% y el riesgo de una enfermedad grave en un 94%.
[Un fármaco experimental frena la progresión del alzheimer en un esperanzador ensayo clínico]
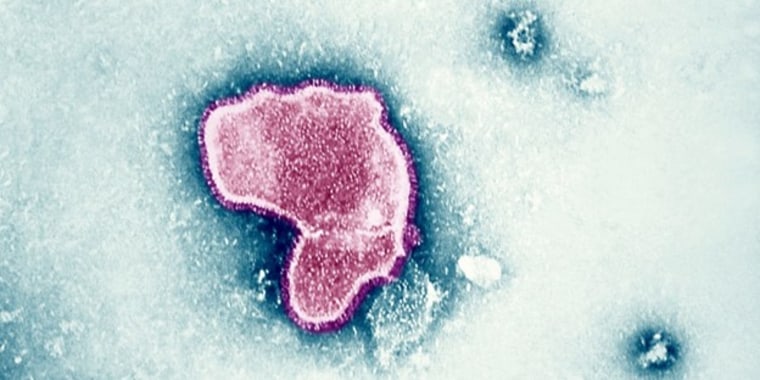
Los Centros para el Control y Prevención de Enfermedades (CDC, por sus siglas en inglés) aún debe emitir una recomendación antes de que la vacuna pueda salir al mercado. Su comité de asesores se reunirá en junio para evaluar si recomienda su uso.
El doctor Phil Dormitzer, vicepresidente de GSK y jefe de desarrollo de vacunas, dijo que ya están elaborando las inyecciones. "El objetivo es que estén disponibles en otoño para que la gente pueda obtenerlas antes de que empiece la temporada a fines de otoño y en invierno", dijo Dormitzer.
[Por qué los casos de tuberculosis subieron en los últimos años]
Los casos de VRS generalmente alcanzan su punto máximo entre fines de diciembre y mediados de febrero, pero en 2022 empezaron a aumentar en el verano, cuando se relajaron las medidas sanitarias por la pandemia de coronavirus.
A fines de abril, la tasa de hospitalizaciones de la temporada era de alrededor de 51 por cada 100,000 personas, según los CDC. Lo que superó las 19 hospitalizaciones por cada 100,000 habitantes registradas el año anterior.
El ensayo clínico de GSK mostró que la protección de su vacuna duró al menos seis meses. “No es como si tuvieras que esperar hasta el último minuto porque su duración será corta”, dijo Dormitzer.
“Sabemos por los estudios que hemos realizado que recibir una inyeccíón, por ejemplo, en el otoño, debería protegerlo para toda la temporada de VRS”, agregó Dormitzer, que dijo que los datos de la compañía también sugieren que es seguro administrar la vacuna del VRS al mismo tiempo que una vacuna estándar contra la gripe.
GSK aún está estudiando si la vacuna se puede administrar junto a las de la gripe de dosis alta o con adyuvante (con un ingrediente adicional para fomentar una mejor respuesta inmunitaria), que son los tipos que recomiendan los CDC para los adultos mayores.
Revisiones de seguridad
La farmacéutica sigue recopilando datos sobre la seguridad del fármaco y continuará recabando información sobre el desempeño de su nueva vacuna en las próximas temporadas de VRS. Hasta ahora, los efectos secundarios comúnmente reportados en el ensayo incluyen dolor en el lugar de la inyección, fatiga y dolor muscular.
La FDA notó una mayor incidencia de ritmo cardíaco irregular entre los que recibieron la vacuna en comparación con el grupo de control e identificó un caso de síndrome de Guillain-Barré, un trastorno inusual que daña las células nerviosas y causa debilidad muscular o parálisis, que estaba potencialmente ligado a la vacuna.
Dormitzer dijo que es difícil saber qué hacer con el caso Guillain-Barré, pero agregó: “No diría que es una gran preocupación en este momento”.
En marzo, un panel de asesores de la FDA votó 10-2 a favor de aprobar la vacuna en función de su seguridad y la recomendó unánimemente en función de su eficacia.
El futuro de las vacunas contra el VRS
Una segunda vacuna de VRS para adultos mayores de la compañía Pfizer será evaluada para su aprobación por la FDA este mes. Un panel que asesora a dicha agencia votó 7-4 a favor de recomendar la dosis por su seguridad y eficacia.
Algunos miembros expresaron su preocupación de que no hubo suficientes participantes en el ensayo de Pfizer contagiados con RSV como para poder determinar adecuadamente la eficacia de la inyección y varios también se preocuparon por una posible asociación con Guillain-Barré. Un hombre que participó en el ensayo de Pfizer desarrolló el síndrome de Guillain-Barré después de recibir la vacuna, y una mujer desarrolló el síndrome de Miller Fisher, una inusual enfermedad del sistema nervioso.
[La soledad es declarada epidemia en EE.UU.: plantea problemas de salud tan graves como fumar]
La FDA ha pedido a Pfizer que realice un estudio sobre el riesgo de Guillain-Barré después de que se apruebe su vacuna.
Pfizer también también hizo pruebas de su vacuna en mujeres embarazadas para ayudar a proteger a sus bebés del VRS. La FDA está revisando esos datos y probablemente emita una decisión en agosto.
Dormitzer dijo que GSK no tiene más planes para estudiar su vacuna entre las personas embarazadas después de que un ensayo anterior con una versión ligeramente diferente de la vacuna mostró una tasa de nacimientos prematuros más alta.
Sin embargo, GSK está estudiando su inyección en personas de 50 a 59 años, en particular aquellas con problemas de salud subyacentes. Dormitzer dijo que los datos deberían estar disponibles en algún momento después de julio.