Por Lauran Neergaard - The Associated Press
La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) aprobó este miércoles el uso de emergencia de la nueva dosis de refuerzo de la vacuna contra el COVID-19, adaptada para hacer frente a la variante ómicron del coronavirus.
Las vacunas, fabricadas por las farmacéuticas Pfizer y Moderna, podrían comenzar a administrarse en unos días, y el Gobierno espera su distribución generalizada tras el feriado de Labor Day.
Las vacunas contra el COVID-19 se desarrollaron contra la cepa original del coronavirus, que inició la pandemia en marzo de 2020, y las nuevas variantes surgidas desde entonces han disminuido su efectividad, aunque siguen siendo claves para evitar fallecimientos.
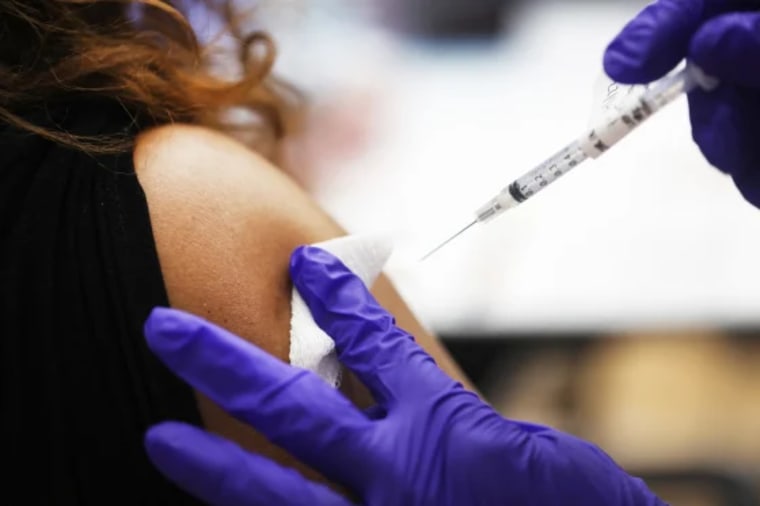
Las nuevas dosis de refuerzo desarrolladas por Pfizer y Moderna son bivalentes, combinando la vacuna original y la protección contra las versiones de omicrón más recientes, denominadas BA.4 y BA.5, consideradas las más contagiosas en este momento.
"Realmente es la mejor oportunidad de protegerse" contra el virus, dijo a The Associated Press la jefa de vacunas de Pfizer, Annaliesa Anderson.
[Jill Biden tiene caso de ‘rebrote’ similar al del presidente y vuelve a dar positivo al COVID-19]
Estos refuerzos adaptados son sólo para las personas que ya se han vacunado con las dosis iniciales, y no deben usarse como vacuna inicial. Las nuevas dosis de Pfizer y su socio BioNTech son para mayores de 12 años; y las de Moderna son para adultos, si han pasado al menos dos meses desde su última dosis recibida.
Queda pendiente que los Centros para el Control y la Prevención de Enfermedades (CDC, en inglés) anuncien su recomendación sobre quién debe recibir esta vacuna adicional. Un panel de expertos lo discutirá este jueves, y luego se tomará la decisión definitiva.
“A medida que nos adentramos en el otoño y empezamos a pasar más tiempo en el interior, animamos encarecidamente a cualquier persona que cumpla los requisitos a que considere la posibilidad de recibir una dosis de refuerzo con una vacuna bivalente para una mejor protección contra las variantes que circulan actualmente”, subrayó en un comunicado el comisionado de la FDA, Robert Califf.
[Menos restricciones pero aún vigilantes: esto dictan las nuevas guías de los CDC para el COVID-19]
Estados Unidos ha comprado más de 170 millones de dosis a las dos empresas. Pfizer dijo que podría enviar hasta 15 millones a finales de la próxima semana.
La duda es si la gente cansada de las vacunas aceptará recibir una nueva dosis. Sólo la mitad de las personas en EE.UU. vacunadas recibieron la primera dosis de refuerzo recomendada, y sólo un tercio de los mayores de 50 años pese a las recomendaciones.
Para el inmunólogo de la Universidad de Pennsylvania E. John Wherry, las autoridades sanitarias deben explicar mejor al público que se debe actualizar la vacuna contra el COVID-19 cada cierto tiempo, al igual que ocurre contra la gripe en otoño o contra el tétanos después de pisar un clavo oxidado.
“Tenemos que volver a dar una imagen socialmente normal”, en lugar de una respuesta de pánico a las variantes, dijo Wherry. “Dar un conjunto de expectativas claras y orientadas al futuro”, agregó.
Las vacunas originales siguen protegiendo de desarrollar una forma grave de COVID-19 o de morir por culpa de la enfermedad a la mayoría de personas sanas, especialmente si recibieron esa importante primera dosis de refuerzo. Se desconoce, sin embargo, cuánto más beneficiará una dosis de refuerzo adaptado, más allá de un aumento temporal de los anticuerpos capaces de defenderse de una infección por ómicron.
[El Gobierno federal dejará de enviar pruebas gratuitas de COVID-19 por correo]
La FDA autorizó las modificaciones antes de realizar estudios en personas, un paso para que las actualizaciones de la vacuna contra el COVID-19 sean más parecidas a las vacunas anuales de la gripe.
En primer lugar, la FDA verificó los estudios en humanos de los intentos anteriores de Pfizer y Moderna de actualizar sus vacunas, inyecciones que coincidían con la cepa ómicron que acechó el invierno pasado. Ese cambio de fórmula era seguro y aumentaba sustancialmente los anticuerpos contra la variante anterior, mejor que otra dosis de la vacuna original, al tiempo que añadía un poco de protección contra BA.4 y BA.5, genéticamente distintas, de hoy.
Pero la FDA ordenó a las farmacéuticas elaborar dosis aún más adaptadas dirigidas a las mutaciones de ómicron más recientes, lo que desencadenó una carrera para lanzar las vacunas en menos de tres meses. En lugar de esperar unos meses más para realizar estudios adicionales en humanos de ese ajuste de la receta, Marks dijo que las pruebas en animales mostraron que la última actualización estimula “una respuesta inmune muy buena”.
La esperanza, dijo, es que una vacuna adaptada a las variantes que se extienden actualmente podría hacer un mejor trabajo en la lucha contra la infección, no sólo contra la enfermedad grave, al menos durante un tiempo.
Mientras las vacunas modificadas se ponen en marcha, Moderna y Pfizer están llevando a cabo estudios en humanos para ayudar a evaluar su valor, incluyendo cómo se mantienen si aparece una nueva cepa.
En cuanto a los niños, Pfizer tiene previsto solicitar a la FDA que autorice la actualización de las vacunas para menores de 5 a 11 años a principios de octubre.