La Administración Federal de Medicamentos y Alimentos (FDA) autorizó este miércoles el uso de emergencia de una dosis de refuerzo de Pfizer-BioNTech contra el COVID-19 para las personas mayores de 65 años, como así también las que tienen más de 18 años pero están en alto riesgo de exposición al coronavirus o de enfermedad grave. El refuerzo debe aplicarse al menos seis meses después de su segunda dosis.
Se considera que están en alto riesgo quienes pueden enfermar de gravedad de coronavirus, y ser hospitalizados por ejemplo, o quienes tienen una probabilidad elevada de contagio y complicaciones al estar más expuestos al virus, como trabajadores de la salud y maestros.
[Respondemos 5 preguntas clave sobre el refuerzo de la vacuna contra el coronavirus]
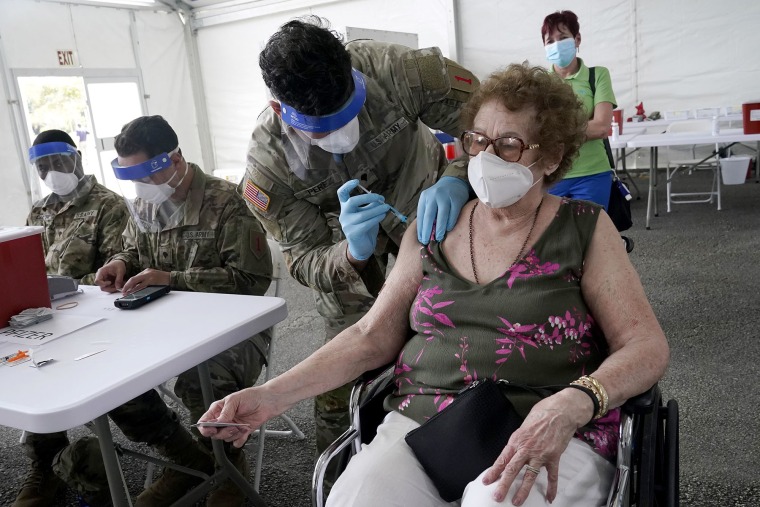
La autorización de emergencia es uno de los pasos necesarios para que el Gobierno de Joe Biden pueda poner en marcha una campaña nacional para administrar las dosis adicionales, tal como lo anunció el mes pasado. Aunque la Administración planeaba dar un refuerzo a toda la población a partir de septiembre, algo que no ha sido avalado por los expertos.
Esto implica que decenas de millones de personas ya inmunizadas reciban otra inyección en farmacias, clínicas de salud, consultorios médicos y otros lugares.
Sin embargo, para que empiece la distribución se necesita aún el visto bueno de un grupo asesor de los Centros para el Control de Enfermedades (CDC, por sus siglas en inglés). El llamado Comité Asesor sobre Prácticas de Inmunización está realizando una reunión de dos días para analizar la seguridad y eficacia de la vacuna de Pfizer, y dará su voto al respecto el jueves.
[Médicos piden con desesperación a las embarazadas que se vacunen]
Las vacunas de Moderna y Johnson & Johnson no están incluidas en esta autorización, por lo que las millones de personas que las han recibido deberán esperar para saber si tendrán otra inyección.
La decisión de la FDA ocurre días después de que un panel de expertos de la agencia hiciera una recomendación similar sobre la necesidad de aplicar una dosis de refuerzo a los más vulnerables, pero no a la población en general.
Pfizer había pedido la autorización de la dosis para todas las personas mayores de 16 años, pero los expertos indicaron que hay preocupación por los posibles efectos secundarios de la vacuna, como la miocarditis, en los adultos más jóvenes.
El comité de los CDC también tuvo un tono escéptico en su reunión de este miércoles sobre la necesidad de una tercera dosis. Algunos pidieron más datos y se preguntaron cuál es el objetivo que se busca: prevenir todas las enfermedades o sólo las graves.
La dosis de refuerzo está destinada a combatir la disminución de la inmunidad con el paso del tiempo, en especial ante variantes nuevas del coronavirus más contagiosas como la delta. Estudios realizados en Israel, presentados ante los expertos, sugieren que la protección decae significativamente después de seis meses. Sin embargo, los datos de EE.UU. muestran una menor caída en la eficacia, especialmente contra la infección grave.
Pfizer solicitó por primera vez la autorización para su vacuna para adultos en noviembre de 2020 y fue aprobada en diciembre. En agosto, la FDA concedió la aprobación completa a la vacuna de dos dosis para mayores de 16 años. Fue la primera vacuna contra el coronavirus que superó este último obstáculo burocrático.
En la actualidad, la vacuna se administra también a niños de 12 a 15 años. Los laboratorios Pfizer y BioNTech afirmaron además esta semana que su vacuna también es segura y efectiva para niños de 5 a 11 años.